点击蓝字 关注我们
1
目的
采用Grow Scoffold,通过寻找适合的替代骨架进行骨架跃迁实现先导化合物优化。
2
所需功能和模块
Discovery Studio Client, DS CHARMM Lite, and DS CATALYST CONFORMATION
3
所需数据文件
1o86_ligand.sd, 1o86_complex.dsv
4
所需时间
30分钟
介绍
骨架跃迁(Scaffold Hopping)是将一个配体的核心骨架替换为一个新的具有类似功能的基团来提高化合物的性质或者寻找具有类似功能的全新化合物。应用这种方法,在充分考虑活性的基础上,可以设计出突破专利保护,结构新颖,且可能改善药物代谢动力学性质的全新药物分子。
在本教程中,我们将使用replace fragment流程来对第三代血管紧张素肽转化酶(ACE)抑制剂赖诺普利进行骨架跃迁。ACE催化非生物活性的十肽血管紧张素I转化为活性的八肽血管紧张素II。血管紧张素II是一个强力的血管收缩剂,并能促进缓激肽(促进血管舒张)的降解。这种双重功效使得ACE在肾素血管紧张素系统(RAS)中发挥关键作用,并使得它成为治疗高血压,心脏衰竭,糖尿病肾病和II型糖尿病中一个非常有前景的靶点。
在本教程中,我们将使用Replace Fragment来寻找赖诺普利中的乙酸脯氨酸子结构的替代结构。主要任务如下:
-
直接基于小分子产生替代片段
-
使用蛋白活性位点优化产生的潜在的替代片段
-
使用不同的性质来识别全新骨架
01
直接基于小分子产生替代片段
在教程的第一部分,我们将使用Replace Fragment流程,只基于配体结构,来发现赖诺普利的乙酰脯氨酸子结构的替代结构。赖诺普利在1983年就被发现,而能够用于基于结构设计的ACE的晶体结构直到2003年才被公布,因此化合物的骨架跃迁经常是在没有蛋白结构下进行的。
1.执行骨架跃迁计算
在文件浏览器(Files Explorer)中,找到并双击打开Samples | Tutorials | Receptor-Ligand Interactions | 1o86_ligand.sd文件.
显示小分子的三维结构。
在分子视图窗口(按住Ctrl+G打开)选中化合物的乙酰脯氨酸的子结构,或者在系统视图(Hierarchy View,按住Crtl+H打开)中,选中化合物的C15, O17, O22-C29原子(图1)。
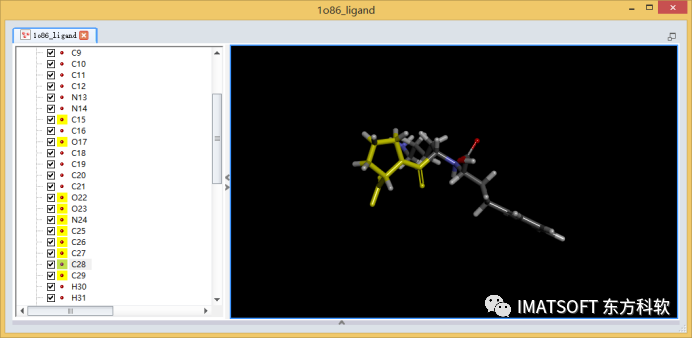
图1 赖诺普利的三维结构,黄色加亮(选中状态)的为乙酰脯氨酸
在工具浏览器(Tools Explorer)中,展开Receptor-Ligand Interactions | Lead Optimization工具栏,单击Replace Fragment…工具,弹出流程窗口。
点击Input Ligand参数,设置为1o86_ligand: 1o86_ligand。
将Fragment to Replace参数设置为Create New Group From Selection…。
其他参数都默认,点击Run按钮,运行作业。
点击Background按钮使作业在后台运行。(图2)
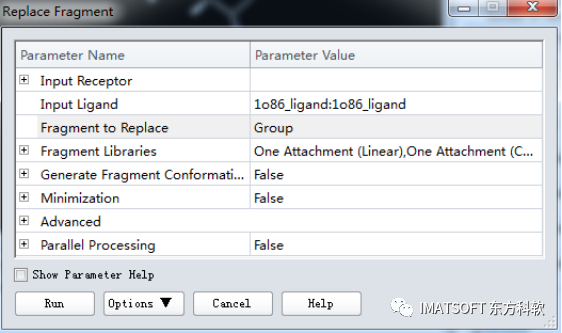
图2 参数设置
作业运行的时间不到3分钟,最后得到99个化合物。
2.查看计算结果
点击作业浏览器(Job explorer)中刚完成的作业,点击View Results链接。
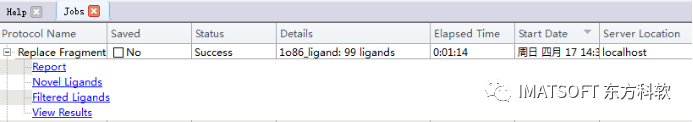
图3 查看计算结果
在表格视图中,点击左侧的 按钮在图像窗口中查看第一化合物,点击表格视图中的
按钮在图像窗口中查看第一化合物,点击表格视图中的 键和
键和 键进行浏览(图4)。
键进行浏览(图4)。
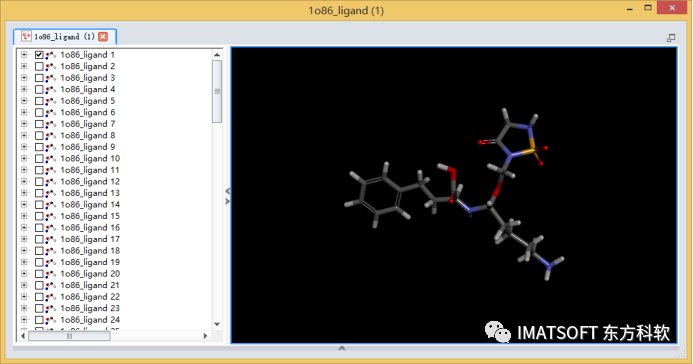
图4 基于配体的骨架跃迁计算结果
由于我们只使用配体结构进行片段替换,因此产生的新化合物只按照不符合Lipinski五规则数目(Lipinski violations)和片段的新颖性来进行排序。结果将给出替换片段与原始片段的相似性,这有利于对分子进行排序,关于相似性,我们在教程的最后一部分还将进行讨论。
如果要考虑每一个匹配的片段,那么所得到的新化合物在数量上对我们来说有可能会太多。目前ACE蛋白质的结构已经被解析出来了,我们可以充分利用这些信息,利用蛋白质的活性位点来对所得片段进行限制,使得产生的的配体能够更好地符合结合位点的情况,提高化合物的可结合性和活性。此外,对于较大的化合物库,你还可以通过计算化合物的ADMET及其他相关的性质来对得到化合物进一步过滤和进行排序。
02
使用蛋白活性位点优化产生的潜在的替代片段
在这个部分,我们将使用ACE的晶体结构来对所产生的可能替代片段进一步优化。我们这里使用的ACE与赖诺普利复合物的晶体结构的pdb号为1O86,该文件从PDB网站下载下来,并且事先已经使用Prepare Protein流程进行优化。
1.执行骨架跃迁计算
在文件浏览器(Files Explorer)中,找到并双击打开 Samples | Tutorials | Receptor-Ligand Interactions | 1o86_complex.dsv文件。
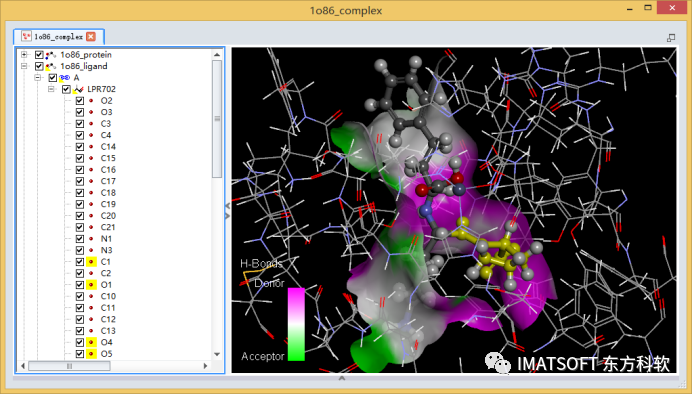
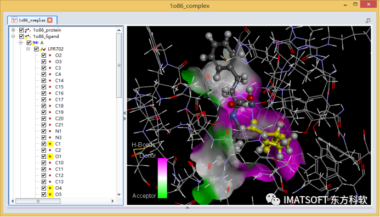
图5 赖诺普利与ACE复合物的晶体结构,黄色高亮为被选中的乙酰脯氨酸
在分子窗口中选中配体的乙酰脯氨酸子结构,或在系统视图中选中配体的C1, O1, O4, O5, N2, C5-C9原子(图5)。
在工具浏览器(Tools Explorer)中,展开Receptor-Ligand Interactions | Lead Optimization工具栏,点击Replace Fragment 工具,打开流程对话框。
将Input Receptor设为1o86_complex: 1o86_protein.
展开Input Receptor参数组, 并将Interacting Residues设置为事先设定的interacting_residues组。
点击Input Ligand参数,将其设为1o86_complex: 1o86_ligand.。
将Fragment to Replace设置为Create New Group From Selection…。
其他参数都为默认参数,点击Run按钮运行作业。
点击Background按钮使作业后台运行。
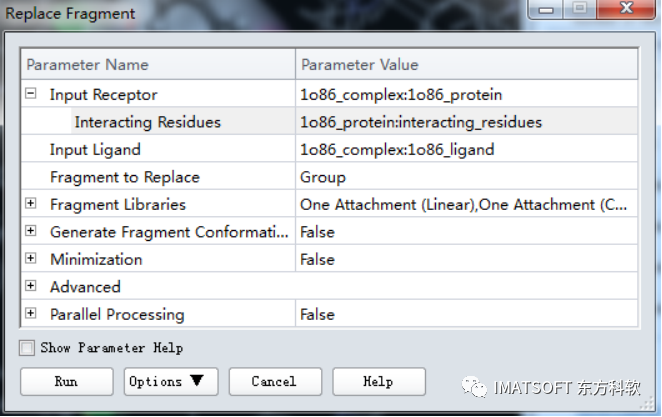
图6 基于活性位点优化的骨架跃迁的参数设置
这个作业大致上要花4分钟,最终将产生43个配体。在这个例子中,活性位点的空间限制将用来对得到的配体进行优化。我们也可以规定产生的配体必须与受体中的残基形成相互作用来进行进一步优化。这里我们选用的残基有GLN281, HIS353, LYS511, HIS513和 TYR520,它们是赖诺普利的乙酰脯氨酸子结构与受体相互作用的残基。
2.查看骨架跃迁优化结果
在作业浏览器(Jobs Explorer)中,展开新完成的作业,点击View Results链接,查看运算结果。(图7)
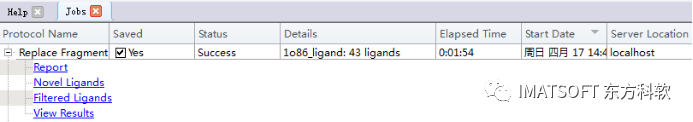
图7 查看计算结果
在表格视图中,点击左侧的 按钮在图像窗口中查看第一化合物,点击表格视图中的
按钮在图像窗口中查看第一化合物,点击表格视图中的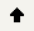 键和
键和 键进行浏览。
键进行浏览。
3.骨架跃迁优化结果分析
非键相互作用的直观显示与分析
在工具浏览器(Tools Explorers)中,展开Receptor-Ligand Interactions | View Interactions,点击Ligand Interactions。
在视图窗口中,受体原子与所产配体间的非键相互作用会通过不同颜色的虚线显示出来,且只有参与了同配体之间的相互作用的残基才会显示。(图8)
图8 显示蛋白-配体之间非键相互作用
点击上述View Interaction工具面板下的 按钮可以观察优化后的分子同蛋白之间的各种非键相互作用。
按钮可以观察优化后的分子同蛋白之间的各种非键相互作用。
为了更好的观察受体分子与配体的相互作用,可以对体系进行旋转以获得最佳的观赏角度。
在这个例子中,由于在片段替换过程中考虑了蛋白的活性位点,因此得到的配体所包含的将按照蛋白的相互作用数(最大),Lipinski违法数(最小化),受体碰撞数(最小)和片段的新颖性(最大化)进行排序。所得到的配体都包含受体-配体相互作用性质,包括蛋白残基,相互作用类型及相互作用距离。所有的配体至少要与interacting_residues group中的一个残基发生相互作用。
03
使用不同的性质来识别全新骨架
在教程的最后一部分,我们通过设置参数来改变程序的运算结果。
1.执行骨架跃迁优化
在工作浏览器(Jobs Explorer)中找到第二部分的运算结果,展开,打开report链接。
在report页面里面展开Parameters,然后点开Protocol.pr_xml链接来打开protocol(图9)。
该protocol包含之前运算protocol的所有参数。
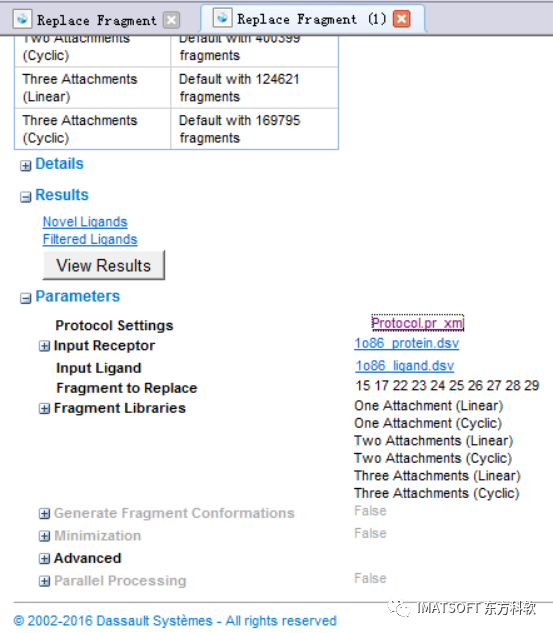
图9 打开上次作业的protocol参数文件
在protocol中展开Advanced | Fragment Search。
点击Properties for Similarity参数上的 按钮,打开对话框。
按钮,打开对话框。
移除右边窗口(selected items)的所有参数,然后添加FCFP_4。
将Maximum Distance参数改为0.7。
其他参数都为默认参数(图10),在流程浏览器窗口中点击鼠标右键,点击run运行作业(或者按F5快捷键),等待作业结束。
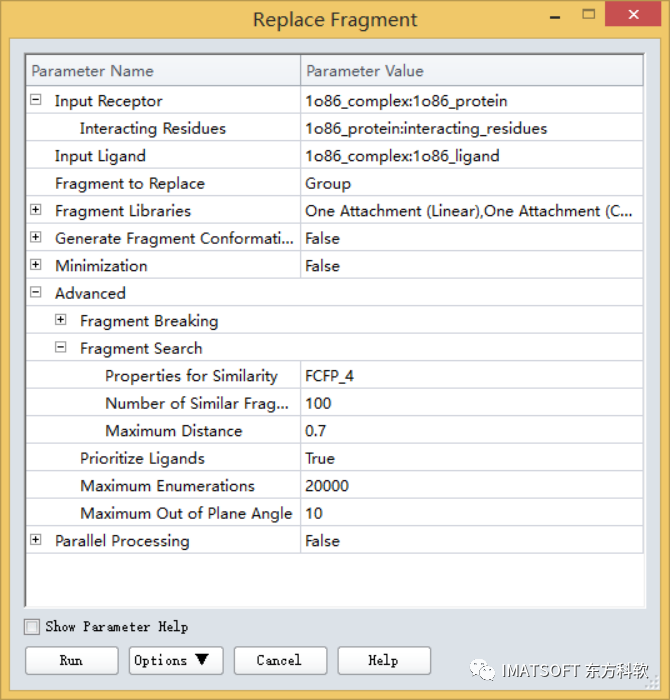
图10 参数设置
这个作业运行不到5分钟,最后得到75个新分子。
需要注意的是,当使用分子指纹的时候,不同片段间的相似性将用Tanimoto系数来进行比较。两个很相似的片段它们间的Tanimoto系数可能会比较低,如使用ECFP_4分子指纹时,苯环和嘧啶间的Tanimoto系数只有0.333。因此,当只用分子指纹进行限定时,为了得到较合理数目的结果,你需要适当地调高Maximum Distance参数。
2.运算结果查看
在作业浏览器(Jobs Explorer)中,展开新完成的作业,点击View Results链接,查看运算结果。
在工具浏览器(Tools Explorers)中,展开Receptor-Ligand Interactions | View Interactions,点击Ligand Interactions。
在视图窗口中,受体原子与所产配体间的非键相互作用会通过不同颜色的虚线显示出来,且只有参与了同配体之间的相互作用的残基才会显示。(图11)

图11 以分子指纹作为骨架新颖性评价标准时的运算结果
点击上述View Interaction工具面板下的 按钮可以观察优化后的分子同蛋白之间的各种非键相互作用。
按钮可以观察优化后的分子同蛋白之间的各种非键相互作用。
为了更好的观察受体分子与配体的相互作用,可以对体系进行旋转以获得最佳的观赏角度。









 苏公网安备 32059002002276号
苏公网安备 32059002002276号
